REACCIONES Y ECUACIONES QUIMICAS
abril 17, 2018
REACCIONES Y ECUACIONES QUÍMICAS
Introducción
Introducción
En este post vamos a estudiar las transformaciones químicas. Son procesos en los que
una serie de sustancias reaccionan para dar otras con propiedades diferentes.
Objetivos
-Entender qué sucede en una reacción química.
-Saber clasificar las reacciones.
-Ser capaz de realizar cálculos a partir de una ecuación química.
Introducción
Hablamos de reacción química cuando las moléculas de los reactivos rompen alguno de
sus enlaces para formar otros nuevos, lo que conlleva la aparición de nuevas sustancias.
Llamamos ecuación química a la expresión en la que aparecen como sumandos las
fórmulas de los reactantes (sustancias que reaccionan) seguidas de una flecha, y las
fórmulas de los productos (sustancias que se producen) también sumándose.
¿QUE ES UNA REACCIÓN QUÍMICA?
La reacción química es aquel proceso químico en el cual dos sustancias o más, denominados reactivos, por la acción de un factor energético, se convierten en otras sustancias designadas como productos. Mientras tanto, las sustancias pueden ser elementos químicos (materia constituida por átomos de la misma clase) o compuestos químicos (sustancia que resulta de la unión de dos o más elementos de la tabla periódica).
El ejemplo más corriente de una reacción química es la formación de óxido de hierro, que resulta de la reacción del oxígeno del aire con el hierro.
Los productos que se obtienen de ciertos reactivos dependerán de las condiciones persistentes en la reacción química en cuestión, aunque, si bien es una realidad esto que se sostiene que los productos varían de acuerdo a las condiciones, determinadas cantidades no sufren ningún tipo de modificación y por tanto permanecen constantes en cualquier reacción química.
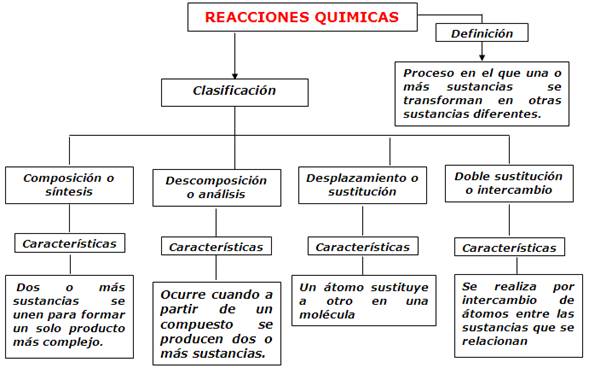
TIPOS DE REACCIONES:
Encontramos muchísimas reacciones químicas diferentes. puesto que es algo inherente a
la ciencia ordenar y clasificarlo todo, ésta no iba a ser una excepción. Dada esta variedad
hay bastantes formas de clasificar las reacciones.
Vamos a estudiar diversas clasificaciones atendiendo a diferentes criterios. Ten en cuenta
que no son excluyentes: una reacción se puede clasificar con todos y cada uno de los
criterios, como verás al final de la página.
Debido a su importancia, desarrollaremos de forma más extensa dos de los criterios de
clasificación : según la transformación y según la partícula transferida.
Aquí tenéis algunos tipos de reacciones:
-Según la velocidad con la que que se desarrolla la reacción:
Dependiendo del tiempo que tardan en consumirse los reactivos encontraremos
reacciones rápidas y lentas.
-Según la energía implicada en el proceso:
Si la reacción desprende energía, la denominamos exotérmica y cuando la absorbe
decimos que es endotérmica. Éstas las desarrollamos en el apartado de energía.
-Según el sentido de la reacción:
Si la reacción se da sólo de reactivos a productos, nos referimos a ella como irreversible.
Si se da también de productos a reactivos (en ambos sentidos), hablamos de reversible.
Por ejemplo, el ácido sulfúrico reacciona con la sacarosa de
forma algo lenta. Si añadimos agua a esta mezcla, la
reacción es rápida. Al principio se va oscureciendo poco a
poco y, al añadir agua, se vuelve negra rápidamente. En
ambos casos se desprende energía , es exotérmica e
irreversible.
SEGÚN EL TIPO DE TRANSFORMACIÓN:
Las clasificamos según la transformación o mecanismo por el que se da la reacción:
-Reacciones de combinación o síntesis:
Partiendo de dos o más sustancias, producen un solo producto:
-Reacciones de descomposición:
Partiendo de un solo reactante, da lugar a varios productos:
-Reacciones de desplazamiento o sustitución:
Son aquellas en las que algún átomo de una de las sustancias que reacciona es desplazado
o sustituido por otro de una sustancia simple:
Reacciones de doble desplazamiento
Es muy parecida a la anterior pero, esta vez, el átomo que entra en la molécula proviene
de un compuesto y el átomo desplazado entra en la molécula del otro compuesto.
SEGÚN LA PARTÍCULA QUE SE TRANSFIERE:
Para esta clasificación nos fijaremos en la partícula que pasa de un reactivo a otro.
-Reacciones de transferencia de protones o ácido-base:
Utilizaremos la teoría de Arrhenius por ser sencilla, aunque completa, y suficiente para
nuestro objetivo. Consideramos ácido a aquella sustancia capaz de ceder protones (H+
en
disolución, llamado más correctamente ión oxonio y representado por H3O
+
) y base a la
que es capaz de ceder iones hidróxido (OH
también llamado oxhidrilo).
Un ión oxonio de la sustancia con características ácidas se une a un oxhidrilo proviniente
de la sustancia básica para dar agua. Los iones restantes se unen para formar una sal.
-Reacciones de transferencia de electrones o de oxidación-reducción:
Son aquellas en las que se verifica la transferencia de electrones entre los reactantes. Para
saber si ha tenido lugar, hay que observar el número de oxidación. En este curso será
suficiente con adoptar como tal la valencia iónica. Si gana electrones, su número de
oxidación disminuye y decimos que se reduce; si los pierde, dicho número aumenta y
hablamos de oxidación.
Las combustiones son procesos en los que una sustancia se oxida (combustible) y otra
se reduce (comburente) liberando gran cantidad de energía y formando gases.
Es preciso que conozcas las combustiones de hidrocarburos, en las que el carbono pasa a
dióxido de carbono y el hidrógeno, a agua. En este caso el comburente es el oxígeno.
Ahora ya tienes claro que una reacción química consiste en la transformación de unas sustancias en otras. Por ejemplo si ponemos en contacto gas oxígeno y gas hidrógeno en las condiciones adecuadas reaccionarán para dar agua líquida. En este ejemplo el oxígeno y el hidrógeno, que son las sustancias que hay inicialmente y que van a "desaparecer" decimos que son las sustancias que reaccionan o los reactivos y el agua que es la nueva sustancia, la que "aparece", decimos que es el producto.
H2 (g) + O2 (g) e H2O (l)
que se lee "el hidrógeno gas reacciona con el oxígeno gas para dar agua líquida" .
Recuerda que las fórmulas químicas recogen información no solo sobre el tipo de átomos que forma cada sustancia pura, sino también sobre la proporción en la que se combinan los distintos tipos de átomos en cada compuesto, y sobre el número exacto de átomos que forman las moléculas en el caso de que se trate de sustancias formados por moléculas (sustancias moleculares). Así en nuestro ejemplo, donde todas las sustancias son de este tipo podemos leer: "una molécula de hidrógeno reacciona con una molécula de oxígeno para dar una molécula de agua". ¿Es ésto cierto?. No, es imposible, no se cumpliría la ley de Lavoisier.
Cada molécula de oxígeno (O2) tiene dos átomos de oxígeno (O) y cada molécula de hidrógeno (H2) tiene dos átomos de hidrógeno (H). Así que con una de cada una de estas moléculas puedo formar una molécula de agua (H2O), que contiene dos átomos de hidrogeno (H) y un átomo de oxígeno (O), pero me sobra un átomo de oxígeno. Si piensas un poco te darás cuenta que partiendo de dos moléculas de hidrógeno (H2) y una de oxígeno puedo obtener dos moléculas de agua y no sobra ningún átomo. Esto que hemos hecho es ajustar una reacción química para que se cumpla el principio de conservación de la masa. Entonces el proceso real se puede representar con la siguiente ecuación química:
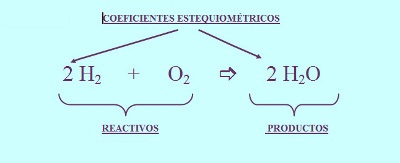
que se lee: "2 moléculas de hidrógeno reaccionan con una molécula de oxígeno para dar dos moléculas de agua". Los números que indican la cantidad de moléculas de cada tipo que participan en la reacción se colocan delante de la correspondiente fórmula y se llaman coeficientes estequiométricos. Observa que el O2 no lleva coeficiente estequiométrico. No es que no lo tenga, pero es 1, y en ese caso no se escribe.
ECUACIÓN QUÍMICA:
ECUACIÓN QUÍMICA:
Una ecuación química es la representación simbólica de una reacción, donde se especifica la parte cualitativa y cuantitativa de los reactantes y productos.
Veamos un esquema general de una ecuación química, donde se especifica las condiciones en la que se transcurre la reacción.

Donde:
→ : simboliza el sentido de la reacción. Indica que A y B se transforman en C y D. El símbolo significa o interpreta como “igual a”, y es lo que la le da a la expresión la categoría de ecuación.
→ Ni : Esta notación se emplea para indicar que la reacción química ocurre en presencia de un catalizador (agentes físicos o químicos que modifican la velocidad de una reacción). En la ilustración el Ni es un catalizador.
200°C y 5 atm : Indica las condiciones de presión y temperatura en las que las sustancias A y B se transforman en C y D.
a, b, c, d : Son coeficientes, generalmente son números enteros, nos indica el número de unidades fórmula de las sustancias.
Otros símbolos importantes que suelen utilizarse en una reacción química son:
(s) : La sustancia está en fase sólida
(l) : La sustancia está en fase líquida
(g) : La sustancia está en fase gaseosa
(ac) : La sustancia está disuelta en agua (solución acuosa)
(sol) : La sustancia está formando una solución o disolución
↑ : Significa que es una sustancia gaseosa y se desprende del reactor químico
↓ : Significa que es una sustancia sólida insoluble en el disolvente donde ocurre la reacción y por lo tanto se precipita en forma de sedimento, por su mayor densidad.
▲ : Simboliza la energía calorífica.
Ejemplo Ilustrativo:
Consideremos inicialmente una mezcla de un pedazo de hierro y agua, la cual una vez sometida al calor experimenta una reacción química formando nuevas sustancias, tal como muestra la figura:

El experimento muestra la reacción del hierro metálico con agua caliente, formándose un sólido rojizo (óxido férrico) y un gas muy ligero (hidrógeno gaseoso). Además el sólido rojizo es insoluble en agua por lo que se precipita, depositándose en el fondo del tubo de ensayo.
La ecuación química balanceada de la reacción será:
2 Fe(s) + 3 H2O (s) → Fe2O3(s) + 3H2(g)
Condición de una ecuación química correcta
Para que una ecuación química esté correctamente escrita, debe cumplir ciertos requisitos:
·Los símbolos y las fórmulas de reactantes y productos deben estar correctamente escritos.
·Deben aparecer moléculas de los elementos y no átomos libres.
Para poder cumplir esta condición, al escribir una ecuación es necesario recordar que las moléculas de los elementos gaseosos y las de los halógenos son diatómicas:
H O2 N2 F2 Cl2 Br2 I2
La ecuación debe cumplir con la Ley de la conservación de la masa de Lavoisier, es decir, el número de átomos debe ser igual en los reactantes y en los productos; debe estar balanceada.
|
¿COMO ESCRIBIR UNA ECUACIÓN QUÍMICA?





.png)
.png)
0 comentarios