mayo 09, 2018
MÉTODOS PARA BALANCEAR ECUACIONES
INTRODUCCIÓN
El propósito de este post compartir conocimientos fundamentales acerca de la química, en este caso me enfocare en el tema del balanceo de ecuaciones, explicare en que consiste este concepto, que cosas debemos tener en cuenta a la hora de llevar a cabo este procedimiento, y aprenderemos a utilizar dos de los métodos más importantes para el balanceo de ecuaciones.
OBJETIVOS
- Comprender que es balanceo.
- Aprender las distintas características que nos permiten construir una ecuación balanceada.
- Conocer algunos métodos para balancear ecuaciones
- Conocer y seguir los pasos en el método de tanteo como en el de redox.
.png)
MARCO TEÓRICO
Balanceo de una reacción química
En una ecuación química, el número de átomos de cada elemento en los reactantes debe ser igual al número de átomos de cada elemento en los productos. A este tipo de ecuación se le conoce como ecuación química equilibrada.
Si se presenta el caso de que el número de átomos no es igual, la ecuación se debe equilibrar o balancear.
Para balancear una ecuación química podemos usar los siguientes métodos:
- Método de tanteo
- Método Redox
- Metodo Algebra
- Metodo Algebra
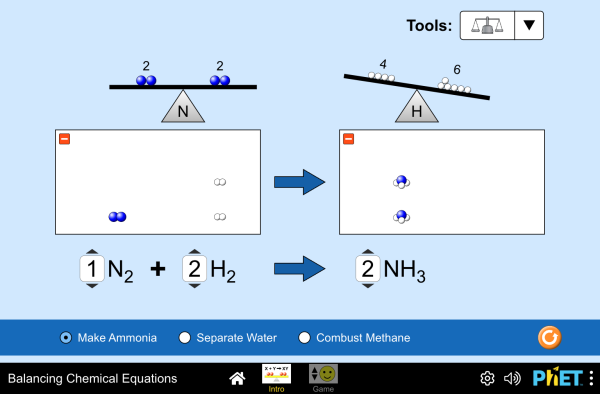
Para conseguir esta igualdad se utilizan los coeficientes estequiométricos, que son números grandes que se colocan delante de los símbolos o fórmulas, para indicar la cantidad de elementos compuestos que intervienen en la reacción química.
Estos no deben ser confundidos con los subíndices que se colocan en los símbolos o fórmulas químicas, ya que estos indican el número de átomos que conforman la sustancia.
Si se modifican los coeficientes, cambian las cantidades de la sustancia, pero si se modifican los subíndices, se originan sustancias diferentes.
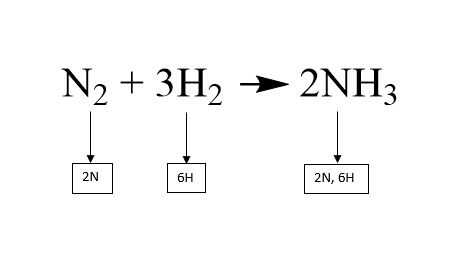
Características:
- Conocer las sustancias reaccionantes y productos.
- Los subíndices señalan la cantidad del átomo indicado en la molécula.
- Los coeficientes afectan a toda la sustancia que preceden.
- El hidrógeno y el oxígeno se equilibran al final, porque generalmente forman agua.
MÉTODOS
- TANTEO
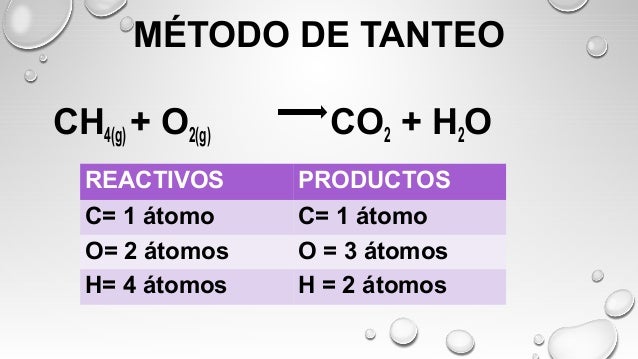
¿Para qué se utiliza?

Para buscar el equilibrio, es decir la misma cantidad de átomos de una reacción química de manera rápida, en ecuaciones sencillas y completas.
Pasos a seguir

- Tener en cuenta que una reacción química al estar en equilibrio, debe mantener la misma cantidad de moléculas o átomos, tanto del lado de los reactivos como del lado de los productos.
- Al haber mayor cantidad de átomos x de un lado, se equilibra completando el número de átomos que tenga en el otro lado de la reacción.
- Se debe seguir este orden:
- Metales
- No metales
- Oxígeno
- Hidrógeno
- Si de un lado existe una cantidad impar, y del otro lado una par, es factible convertir la cantidad impar en par multiplicándola por 2.
Ejemplo:
CaF2+ H2SO4 ----> CaSO4 + HF
1. Balanceamos los metales, que en este caso es el Calcio.
CaF2+ H2SO4 ----> CaSO4 + HF
2. Como podemos darnos cuenta en cada lado el Calcio esta balanceado ya que hay una molécula de cada una a ambos lados.
3. Continuamos balanceando los no metales, que en este caso son el Azufre y el Flúor.
CaF2+ H2SO4 ----> CaSO4 + HF
4. En este caso tenemos una molécula de Azufre en ambas partes, pero de Flúor 2 al lado izquierdo y 1 al lado derecho, aquí es donde tenemos que balancear.
CaF2+ H2SO4 ----> CaSO4 + 2HF
5. Cabe mencionar que para balancear una ecuación se deben colocar el coeficiente respectivo para balancear al elemento pero afecta a todo el reactivo, en este caso afecta el Hidrógeno y el Flúor.
6. Finalmente balanceamos al Hidrógeno
CaF2+ H2SO4 ----> CaSO4 + 2HF
7. El cual ya está balanceado ya que tenemos 2 moléculas de Hidrógeno a cada lado. Y de la misma manera queda balanceada nuestra ecuación.

OXIDO-REDUCCIÓN




OXIDO-REDUCCIÓN



¿Para qué se utiliza?
Se basa en el hecho de que el aumento de los números de la oxidación de los reactantes que han sido oxidados tiene que ser idéntico a la disminución de los números de oxidación de los reactantes que han sido reducidos.
Ejemplo:
1. Escribir la ecuación química:
MnO2 + HCl ----> MnCl2 + H2O + Cl2
2. Asignar el número de oxidación a cada elemento
Mn+4O2-2+ H+1Cl-1----> Mn+2Cl2-1+H2+1O-2+ Cl20
3. Se escriben los elementos que cambian su estado de oxidación
Mn+4---->Mn+2
Cl-1 ---->Cl20
4. El manganeso por tener un estado de oxidación menor al que tenía antes se deduce que se redujo 2 electrones (ganó 2 electrones) y el cloro como aumento su estado de oxidación se oxidó (pérdida de electrones).
Mn+4---->Mn+2 Reducción
Cl-1 ---->Cl20 Oxidación
5. Se realiza el balance de masas, como el cloro del lado derecha de la flecha tiene subíndice dos, lo que indica que hay 2 átomos de cloro, por lo que en los reactivos tienen que haber 2 átomos de este.
Mn+4 ---->Mn+2
2Cl-1 ----> Cl20
6.Se señala el número de electrones ganados y perdidos, en la semirreacción del cloro se coloca dos electrones porque el único electrón que se perdía se multiplica por el dos.
Mn+4-2e ---->Mn+2
2Cl-1+2e----> Cl20
7. Como el número de electrones perdidos es igual al número de electrones ganados no es necesario multiplicar en cruz.
8. Se suman las semirreaciones:
Mn+4-2e ---->Mn+2
2Cl-1+2e ----> Cl20
———————————–
Mn + 2Cl ----> Mn + Cl2
9. Se traslada esto a la ecuación original, los coeficientes que tengan se ponen donde el elemento se encontraba
MnO2+2HCl----> MnCl2+H2O+Cl2
10. Se procede a verificar por tanteo:
Como en los productos hay cuatro cloros se cambia el dos por un cuatro. Pero entonces habrían más hidrógenos en los reactivos. Se soluciona poniendo un dos en el agua.
MnO2+4HCl —> MnCl2+2H2O+Cl2
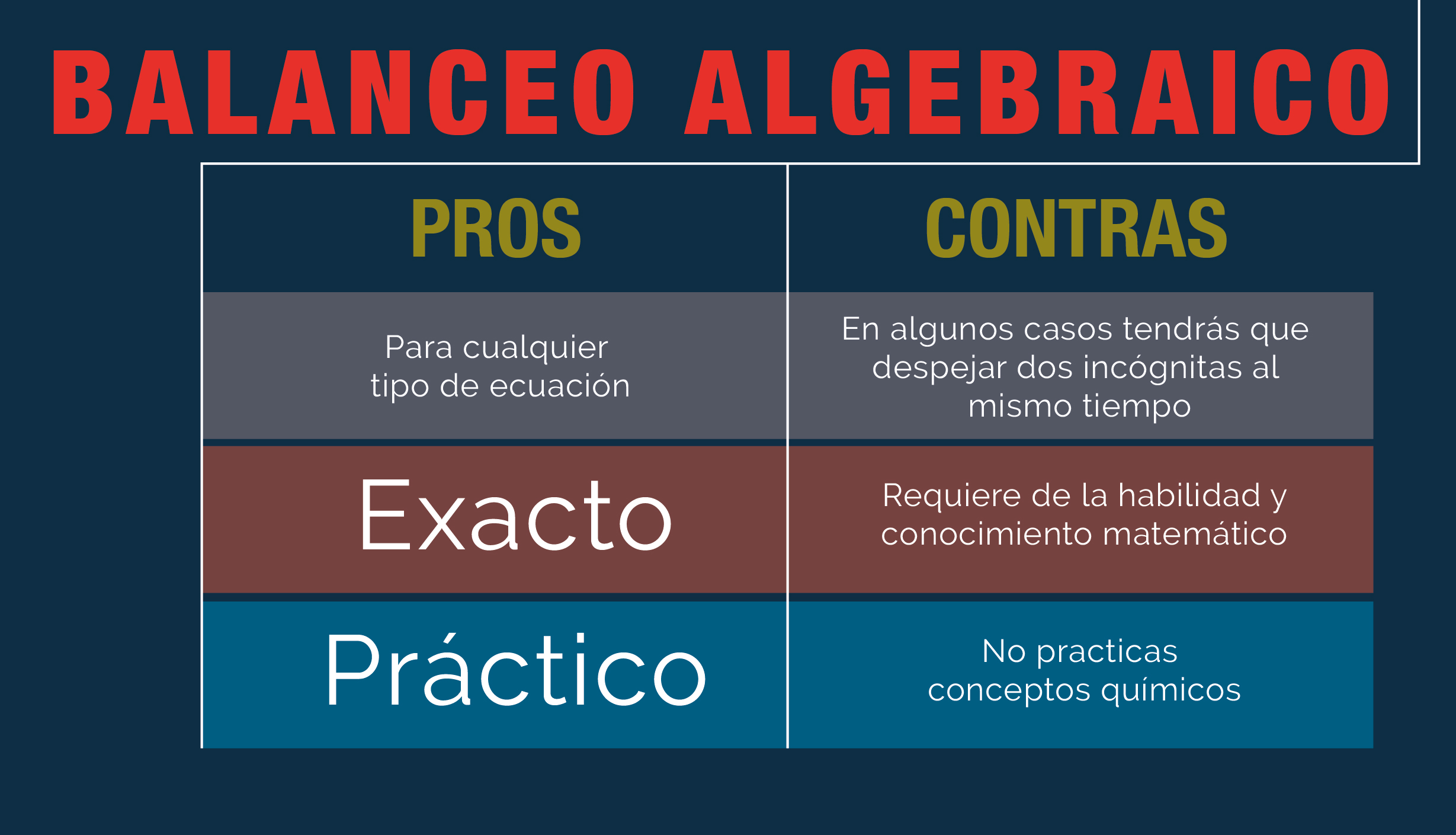
MÉTODO ALGEBRAICO
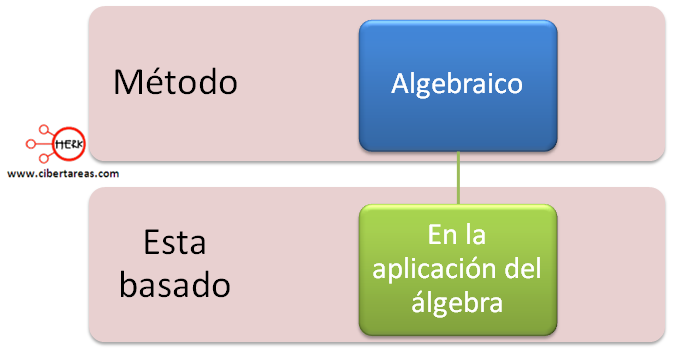
Este método es un proceso matemático que consistente en asignar literales a cada una de las especies, crear ecuaciones en función de los átomos y al resolver las ecuaciones, determinar el valor de los coeficientes.
Este método nos permite detectar si una reacción química está mal planteada, por ejemplo puede suceder que un compuesto no esté bien colocado, pues debe de estar en el otro miembro de la ecuación, esto se apreciara si alguno de los coeficientes resultar negativo al resolver el sistema de ecuaciones, por lo que resultara poco práctico en caso de que se planteara un sistema simultaneo con muchas variables y a la vez nos llevaría a una solución complicada; para explicar este método resolveremos la siguiente reacción.


PROCEDIMIENTO
CONCLUSIONES
- Los métodos que normalmente son utilizados son los de oxido-reducción y el de tanteo, de igual manera existen otros que no se usan con frecuencia como por ejemplo el balanceo algebraico.
- Es importante llevar un orden, el cual consiste en balancear primero los metales, posteriormente los no metales, después el hidrógeno y en última instancia el oxígeno.
WEBGRAFÍA
http://bioquimica173.blogspot.com/2014/02/quimica-organica.html
https://cloud.educaplay.com/recursos/81/2621192/imagen_1_1476585918.gif
https://es.slideshare.net/aeroscristh/balanceo-de-ecuaciones-qumicas-30434345
http://grupos.emagister.com/debate/un_rinconcito_para_mimar_a_nuestros_ninos/17793-799359/p35
https://www.slideshare.net/paracelso2388/power-point-mario-estequiometra
https://bukowski.suffieldacademy.org/marinaghazarian/2018/01/22/chem-talk-section-4-physical-properties-of-metals/
https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgbl3KF6Op7wRh5S2CCIHDDX9WmarS13mHuOhcg7W6cLMRVe1Y0k6XxgZ64MqGT7zu8A6ZohpX_i4ouUVubvkd6CIUKKZHTDZRzRLxdWUMo9Ap4XEHxftrahT8v4a5hxELiXZ72jL0-Xho/s1600/leyes.gif
http://balanceoquimica3.blogspot.com.co/2007/08/balanceo-por-tanteo.html
https://es.slideshare.net/TonyHenriquezPalacio/mtodo-de-tanteo-qumica
https://es.wikihow.com/balancear-ecuaciones-qu%C3%ADmicas
https://www.spanishged365.com/371/balanceo-de-ecuaciones-quimicas
https://quimicadaniel.wordpress.com/2014/09/23/expresion-de-la-constante-de-equilibrio-ke-o-kc/
http://infoparlantes.blogspot.com/2010/08/equilibrio-de-ecuaciones-quimicas.html





.png)
.png)
0 comentarios