NEUTRALIZACION
noviembre 07, 2018
NEUTRALIZACION
INTRODUCCIÓN
Las reacciones ácido-base llamadas también de neutralización se llevan a cabo normalmente en disolución de ambos reactivos. Las bases más frecuentes son los hidróxidos y las reacciones que dan con los ácidos son del tipo general:
ácido + hidróxido → sal + agua
Para determinar la concentración de una disolución de un ácido o de una base, el método más empleado es el conocido como valoración ácido-base. La valoración se lleva a cabo haciendo reaccionar una disolución que contiene una concentración conocida de base (o ácido), con una disolución de ácido (o de base) de concentración desconocida. El procedimiento básicamente consiste en medir el volumen de la disolución (VX) de base (o ácido) necesario para que reaccione (neutralice) con todo el ácido (o base).
En el momento de lograrse la neutralización completa se alcanza el punto de equivalencia, entonces se cumple la siguiente relación:
NA x VA = NB x VB (Ec.1)
Donde NX es la normalidad de la disolución de ácido (A) o base (B).
Para ello, un volumen conocido de la disolución problema se situará en un matraz erlenmeyer, mientras que para la disolución valorante se empleará una bureta con la que mediremos el volumen utilizado hasta alcanzar el punto de equivalencia.
El punto de equivalencia se determinará utilizando un indicador colorimétrico. Estos compuestos indicadores son ácidos (o bases) orgánicos que se caracterizan por tener distinto color la molécula y el ion que resulta de ella. Existen varios tipos de indicadores colorimétricos, cada uno de ellos cambia de color (viraje) en un intervalo de pH diferente. Debemos elegir un indicador cuyo intervalo de viraje coincida con el salto de pH que se produce en el punto de equivalencia de la neutralización que estamos ensayando.
Por último, hay que mencionar que la valoración de una base fuerte o débil, suele efectuarse con un ácido fuerte, generalmente nítrico, clorhídrico o sulfúrico. Las concentraciones de las disoluciones ácida y alcalina deben ser aproximadamente iguales.
OBJETIVOS
Identificar y diferenciar un ácido de una base.
Experimentar y comprender el uso de indicadores ácido- base.
Valorar el carácter básico por adición de ácido de una sustancia.
MARCO TEÓRICO
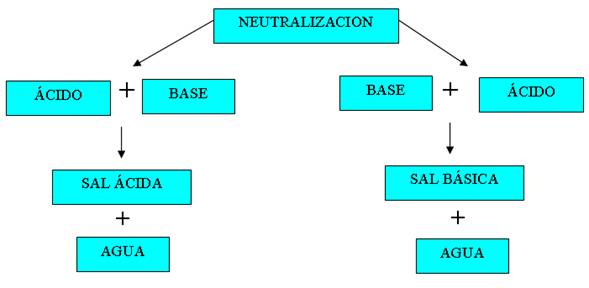
La reacción entre un ácido y una base se llama neutralización. Cuando en la reacción participan un ácido fuerte y una base fuerte se obtiene una sal y agua. Si una de las especies es de naturaleza débil y la neutralización se produce en disolución acuosa también se obtiene su respectiva especie conjugada y agua. Se puede decir que la neutralización es la combinación de iones hidronio y de aniones hidróxido para formar moléculas de agua. Durante este proceso se forma una sal.
Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor.
Podemos resumir el proceso así:
ácido + base → sal + agua
| Neutralización |
Sal disuelta
| |||||||
Ácido fuerte
|
+
|
Base fuerte
|
→
|
Agua
|
+
|
Sal
|
Anión inerte + Catión inerte
| |
Ácido fuerte
|
+
|
Base débil
|
→
|
Agua
|
+
|
Sal
|
Ácido /Base conjugados + Anión inerte
| |
Ácido débil
|
+
|
Base fuerte
|
→
|
Agua
|
+
|
Sal
|
Ácido/Base conjugados + Catión inerte
| |
Ácido débil
|
+
|
Base débil
|
→
|
Agua
|
+
|
Sal
|
Ácido/Base conjugados + Ácido/Base conjugados
| |
EJEMPLOS DE REACCIONES DE NEUTRALIZACIÓN
Cuando el ácido clorhídrico es neutralizado por el hidróxido de sodio, dando como resultado agua y una sal (cloruro de sodio).
HCl(ac) + NaOH(ac) → H2O(l) + NaCl(ac)
Cuando ocurre un derrame de ácido sulfúrico (H2SO4) transportado por un camión, se hace necesario en forma inmediata buscar la manera de evitar que este ácido provoque daños al medio ambiente o las personas, por lo cual los procedimientos de seguridad apuntan a neutralizar las propiedades del ácido, lo cual se hace con una base, cómo es el caso donde se utiliza hidróxido de sodio (NaOH).
Lo que vemos en la ecuación química:
H2SO4(ac) + 2NaOH(ac) → 2H2O(l) + Na2SO4(ac)
En general las reacciones de neutralización tienen diversas aplicaciones como:
En el campo de la salud cuando alguna persona se encuentra con mucha acidez estomacal, toma un antiácido para solucionar su problema. Cómo es el caso del bicarbonato de sodio (NaHCO3) que reacciona con el ácido clorhídrico del estómago (HCl):
NaHCO3(ac) + HCl(ac) → NaCl(ac) + H2O + CO2(g) Produciéndose la neutralización de la acidez.
Cuando a nivel de laboratorio se precisa saber la concentración de una solución o el punto de neutralización, se utilizan métodos volumétricos. Utilizando la fórmula:
N1V1 = N2V2
Donde N representa la normalidad y V representa el volumen.
Los subíndices corresponden a la solución 1 y 2 respectivamente.
Cuando a nivel industrial se utiliza la neutralización de un ácido o una base, para los efluentes del proceso industrial, logrando de esta manera residuos líquidos con un pH neutro y también, de esta manera no contaminar el medio ambiente.
Las neutralizaciones también se utilizan en diferentes procesos industriales, tal como ocurre en la metalurgia, en fábricas de alimentos, de refinamiento de aceites, de cosméticos, de textiles, etc.
Hidròxido de potasio+Àcido Nitrico:
Hidròxido de potasio+Àcido clorhìdrico
Hidròxido de sodio+Àcido Sulfurico
Hidròxido de potasio+ Àcido nítrico
CONCLUSIONES:
Finalizada la experiencia puede concluirse que haciendo reaccionar un ácido con una base, se produce una neutralización donde el pH se equilibra llegando a valer 7 y obteniéndose una sal y a su vez, agua. Suelen ser reacciones exotérmicas donde se libera calor.
WEBGRAFIA:
http://www.escolares.net/quimica/reacciones-de-neutralizacion/
https://www.lifeder.com/reaccion-neutralizacion/
https://www.ecured.cu/Reacci%C3%B3n_de_neutralizaci%C3%B3n




.png)
.png)
0 comentarios